电导法测定乙酸乙酯皂化反应的速率常数
07化四 20072401175 钟国莉
指导老师:李国良 小组成员:肖玉婵 黄婷 钟国莉
【实验目的】
①学习电导法测定乙酸乙酯皂化反应速率常数的原理和方法以及活化能的测定方法;
②了解二级反应的特点,学会用图解计算法求二级反应的速率常数;
③熟悉电导仪的使用。
【实验原理】
(1)速率常数的测定
乙酸乙酯皂化反应时典型的二级反应,其反应式为:
CH3COOC2H5+NaOH = CH3OONa+C2H5OH
t=0 C0C00 0
t=t Ct Ct C0- Ct C0-Ct
t=∞ 0 0 C0C0
速率方程式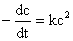 ,积分并整理得速率常数k的表达式为:
,积分并整理得速率常数k的表达式为:
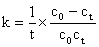
假定此反应在稀溶液中进行,且CH3COONa全部电离。则参加导电离子有Na+、OH-、CH3COO-,而Na+反应前后不变,OH-的迁移率远远大于CH3COO-,随着反应的进行,
OH-不断减小,CH3COO-不断增加,所以体系的电导率不断下降,且体系电导率(κ)
的下降和产物CH3COO-的浓度成正比。
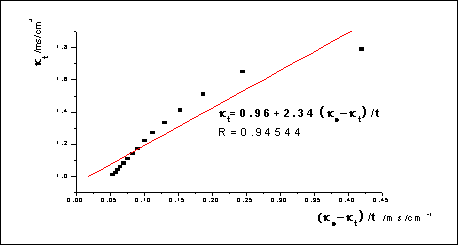
令 、
、 和
和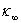 分别为0、t和∞时刻的电导率,则:
分别为0、t和∞时刻的电导率,则:
t=t时,C0?Ct=K( -
- ) K为比例常数
) K为比例常数
t→∞时,C0=K( -
-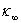 )
)
联立以上式子,整理得:
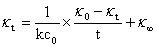
可见,即已知起始浓度C0,在恒温条件下,测得 和
和 ,并以
,并以 对
对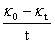 作图,可得一直线,则直线斜率
作图,可得一直线,则直线斜率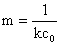 ,从而求得此温度下的反应速率常数k。
,从而求得此温度下的反应速率常数k。
(2)活化能的测定原理:
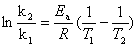
因此只要测出两个不同温度对应的速率常数,就可以算出反应的表观活化能。
【仪器与试剂】
电导率仪 1台 铂黑电极 1支 大试管 5支
恒温槽 1台 移液管 3支
氢氧化钠溶液(1.985×10-2mol/L) 乙酸乙酯溶液(1.985×10-2mol/L)
【实验步骤】
①调节恒温槽的温度在26.00℃;
②在1-3号大试管中,依次倒入约20mL蒸馏水、35mL 1.985×10-2mol/L的氢氧化钠溶液和25mL1.985×10-2mol/L乙酸乙酯溶液,塞紧试管口,并置于恒温槽中恒温。
③安装调节好电导率仪;
④ 的测定:
的测定:
从1号和2号试管中,分别准确移取10mL蒸馏水和10mL氢氧化钠溶液注入4号试管中摇匀,至于恒温槽中恒温,插入电导池,测定其电导率 ;
;
⑤ 的测定:
的测定:
从2号试管中准确移取10mL氢氧化钠溶液注入5号试管中至于恒温槽中恒温,再从3号试管中准确移取10mL乙酸乙酯溶液也注入5号试管中,当注入5mL时启动秒表,用此时刻作为反应的起始时间,加完全部酯后,迅速充分摇匀,并插入电导池,从计时起2min时开始读 值,以后每隔2min读一次,至30min时可停止测量。
值,以后每隔2min读一次,至30min时可停止测量。
⑥反应活化能的测定:
在35℃恒温条件下,用上述步骤测定 值。
值。
【数据处理】
①求26℃的反应速率常数k1,将实验数据及计算结果填入下表:
恒温温度=28.00℃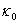 =2.29ms·cm-1
=2.29ms·cm-1
V乙酸乙酯=10.00mL [乙酸乙酯]=1.9850×10-2mol/L
VNaOH=10.00mL [NaOH]=1.9850×10-2mol/L
c0=0.5×1.9850×10-2mol/L
实验数据记录及处理表1:
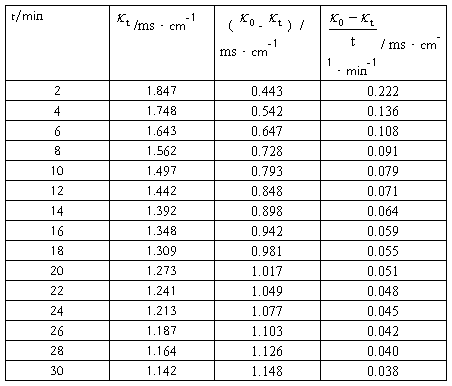
图1: -
-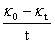 :
:
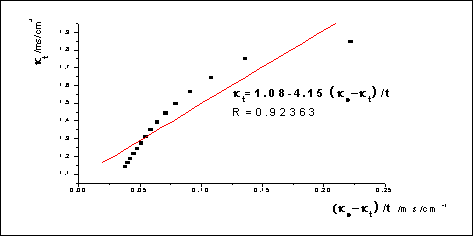
数据处理: 对
对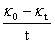 作图,求出斜率m,并由
作图,求出斜率m,并由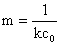 求出速率常数
求出速率常数
m=4.15,k1=1/(mc0)=1/(4.15*1.9850*0.5*10-2)mol·L-1·min=24.3L/(mol·min)
文献参考值:k(298.2K)=(6±1)L/(mol·min)
②采用同样的方法求35℃的反应速率常数k2,计算反应的表观活化能Ea:
a、35℃的反应速率常数k2
恒温温度=35.00℃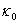 =2.63ms·cm-1
=2.63ms·cm-1
V乙酸乙酯=10.00mL [乙酸乙酯]=1.9850×10-2mol/L
VNaOH=10.00mL [NaOH]=1.9850×10-2mol/L
c0=0.5×1.9850×10-2mol/L
实验数据记录及处理表2:
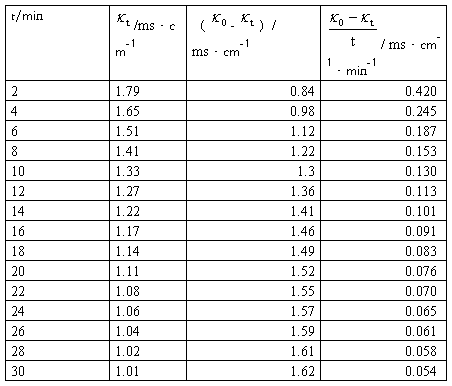
图2: -
-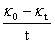 :
:
m=2.34,k1=1/(mc0)=1/(2.34*1.9850*0.5*10-2)mol·L-1·min=43.1L/(mol·min)
文献参考值:k(308.2K)=(10±2)L/(mol·min)
b.计算反应的表观活化能:
∵k1/k2=m2/m1
∴ln(k2/k1)=Ea/R·(1/T1-1/T2) ln(m1/m2)=Ea/R·(1/T1-1/T2)
∴Ea=Rln(m1/m2)·[T1T2/(T2-T1)]
=8.314×ln(4.15÷2.34)×[308×299÷(308-299)]J/mol
=48.7kJ/mol
文献值:Ea=46.1kJ/mol
相对误差:(48.7-46.1)÷46.1×100%=5.64%
【结果分析与讨论】
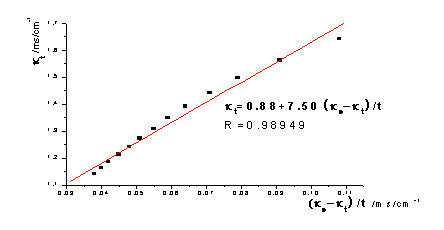
①根据本实验中测定的数据作 -
-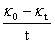 图,图形为抛物线并非直线:乙酸乙酯皂化反应为吸热反应,混合后体系温度降低,所以在混合后的几分钟所测溶液的电导率偏低。如果从6min开始测定,即去掉前两个数据,重新作图,则
图,图形为抛物线并非直线:乙酸乙酯皂化反应为吸热反应,混合后体系温度降低,所以在混合后的几分钟所测溶液的电导率偏低。如果从6min开始测定,即去掉前两个数据,重新作图,则 -
-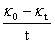 图线性提高了。以26.0℃数据为例作图对比:
图线性提高了。以26.0℃数据为例作图对比:
去点前:
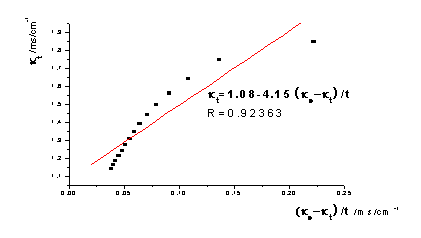
去点后:
②作 -
-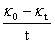 图得斜率m,根据m求出k值约为文献值的4倍:
图得斜率m,根据m求出k值约为文献值的4倍:
26.0℃:
m=4.15,k1=1/(mc0)=1/(4.15*1.9850*0.5*10-2)mol·L-1·min=24.3L/(mol·min)
文献参考值:k(298.2K)=(6±1)L/(mol·min)
35.0℃:
m=2.34,k1=1/(mc0)=1/(2.34*1.9850*0.5*10-2)mol·L-1·min=43.1L/(mol·min)
文献参考值:k(308.2K)=(10±2)L/(mol·min)
分析原因:实验过程中加入乙酸乙酯后没有充分混合就开始测定,由于电导率仪处于主要是乙酸乙酯的环境氛围内,所以测定的κt偏小,而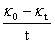 值偏大,则作图所得斜率偏小。由于实验过程中,加入乙酸乙酯的操作及插放电导率仪的操作都由我完成的,所以在不同温度下所测定的数据都出现的相同程度的负偏差。
值偏大,则作图所得斜率偏小。由于实验过程中,加入乙酸乙酯的操作及插放电导率仪的操作都由我完成的,所以在不同温度下所测定的数据都出现的相同程度的负偏差。
【提问与思考】
①为何本实验要在恒温条件进行,而CH3COOC2H5和NaOH溶液在混合前还要预先恒温?
答:因为反应速率k受温度的影响大,(kT+10)/kT=2~4,若反应过程中温度变化比较大,则测定的结果产生的误差较大;反应物在混合前就预先恒温是为了保证两者进行反应的时候是相同温度的,防止两者温差带来温度的变化影响测定结果。
②为什么CH3COOC2H5和NaOH起始浓度必须相同,如果不同,试问怎样计算k值?如何从实验结果来验证乙酸乙酯反应为二级反应?
答:因为乙酸乙酯的皂化反应是二级反应,为了简化计算,采用反应物起始浓度相同。如果不同,则k=1/t(a-b)·ln[b(a-x)/a(b-x)]。选择不同浓度的CH3COOC2H5和NaOH溶液,测定不同浓度的反应物在相同反应条件下的反应速率。
③有人提出采用pH法测定乙酸乙酯皂化反应速率常数,此法可行吗?为什么?
答:可以。CH3COOC2H5+OH-=CH3COO-+C2H5OH,反应速率方程为:v=dx/dt=k(a-x)(b-x),当起始浓度相同(a=b),对该式积分简化得:k=x/ta(a-x)。设t时刻溶液的pH值为ε(t),则此时溶液OH-的浓度为ct(OH-)=10(pH-14),即a-x=10(pH-14),ka=[a-10(pH-14)]/[t·10(pH-14)],用a-10(pH-14)对[t·10(pH-14)作图,可得一条直线,该直线的斜率m=ka,即k=m/a。
④为什么要将电导率仪的温度旋钮选为“25”?
答:测量值就是待测液在实际温度下未经补偿的原始电导率值。
第二篇:电导法测定乙酸乙酯皂化反应的速率常数含思考题答案
电导法测定乙酸乙酯皂化反应的速率常数
07化四 20072401175 钟国莉
指导老师:李国良 小组成员:肖玉婵 黄婷 钟国莉
【实验目的】
①学习电导法测定乙酸乙酯皂化反应速率常数的原理和方法以及活化能的测定方法;
②了解二级反应的特点,学会用图解计算法求二级反应的速率常数;
③熟悉电导仪的使用。
【实验原理】
(1)速率常数的测定
乙酸乙酯皂化反应时典型的二级反应,其反应式为:
CH3COOC2H5+NaOH = CH3OONa+C2H5OH
t=0 C0C00 0
t=t Ct Ct C0- Ct C0-Ct
t=∞ 0 0 C0C0
速率方程式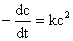 ,积分并整理得速率常数k的表达式为:
,积分并整理得速率常数k的表达式为:
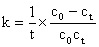
假定此反应在稀溶液中进行,且CH3COONa全部电离。则参加导电离子有Na+、OH-、CH3COO-,而Na+反应前后不变,OH-的迁移率远远大于CH3COO-,随着反应的进行,
OH-不断减小,CH3COO-不断增加,所以体系的电导率不断下降,且体系电导率(κ)
的下降和产物CH3COO-的浓度成正比。
令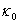 、
、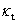 和
和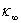 分别为0、t和∞时刻的电导率,则:
分别为0、t和∞时刻的电导率,则:
t=t时,C0?Ct=K(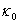 -
-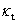 ) K为比例常数
) K为比例常数
t→∞时,C0=K(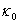 -
-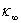 )
)
联立以上式子,整理得:
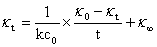
可见,即已知起始浓度C0,在恒温条件下,测得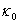 和
和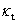 ,并以
,并以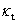 对
对 作图,可得一直线,则直线斜率
作图,可得一直线,则直线斜率 ,从而求得此温度下的反应速率常数k。
,从而求得此温度下的反应速率常数k。
(2)活化能的测定原理:
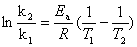
因此只要测出两个不同温度对应的速率常数,就可以算出反应的表观活化能。
【仪器与试剂】
电导率仪 1台 铂黑电极 1支 大试管 5支
恒温槽 1台 移液管 3支
氢氧化钠溶液(1.985×10-2mol/L) 乙酸乙酯溶液(1.985×10-2mol/L)
【实验步骤】
①调节恒温槽的温度在26.00℃;
②在1-3号大试管中,依次倒入约20mL蒸馏水、35mL 1.985×10-2mol/L的氢氧化钠溶液和25mL1.985×10-2mol/L乙酸乙酯溶液,塞紧试管口,并置于恒温槽中恒温。
③安装调节好电导率仪;
④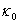 的测定:
的测定:
从1号和2号试管中,分别准确移取10mL蒸馏水和10mL氢氧化钠溶液注入4号试管中摇匀,至于恒温槽中恒温,插入电导池,测定其电导率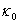 ;
;
⑤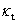 的测定:
的测定:
从2号试管中准确移取10mL氢氧化钠溶液注入5号试管中至于恒温槽中恒温,再从3号试管中准确移取10mL乙酸乙酯溶液也注入5号试管中,当注入5mL时启动秒表,用此时刻作为反应的起始时间,加完全部酯后,迅速充分摇匀,并插入电导池,从计时起2min时开始读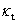 值,以后每隔2min读一次,至30min时可停止测量。
值,以后每隔2min读一次,至30min时可停止测量。
⑥反应活化能的测定:
在35℃恒温条件下,用上述步骤测定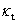 值。
值。
【数据处理】
①求26℃的反应速率常数k1,将实验数据及计算结果填入下表:
恒温温度=28.00℃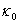 =2.29ms·cm-1
=2.29ms·cm-1
V乙酸乙酯=10.00mL [乙酸乙酯]=1.9850×10-2mol/L
VNaOH=10.00mL [NaOH]=1.9850×10-2mol/L
c0=0.5×1.9850×10-2mol/L
实验数据记录及处理表1:
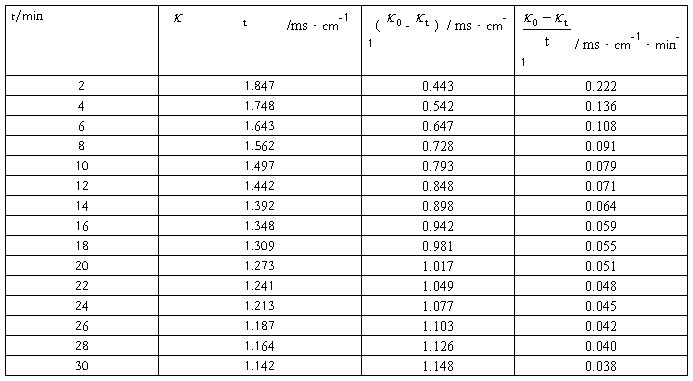
图1: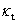 -
- :
:
数据处理: 对
对 作图,求出斜率m,并由
作图,求出斜率m,并由 求出速率常数
求出速率常数
m=4.15,k1=1/(mc0)=1/(4.15*1.9850*0.5*10-2)mol·L-1·min=24.3L/(mol·min)
文献参考值:k(298.2K)=(6±1)L/(mol·min)
②采用同样的方法求35℃的反应速率常数k2,计算反应的表观活化能Ea:
a、35℃的反应速率常数k2
恒温温度=35.00℃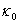 =2.63ms·cm-1
=2.63ms·cm-1
V乙酸乙酯=10.00mL [乙酸乙酯]=1.9850×10-2mol/L
VNaOH=10.00mL [NaOH]=1.9850×10-2mol/L
c0=0.5×1.9850×10-2mol/L
实验数据记录及处理表2:
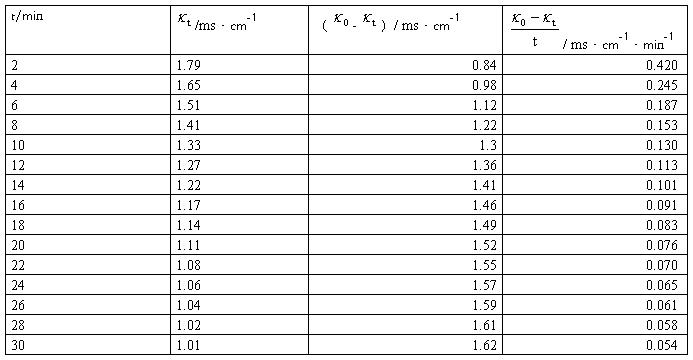
图2: -
- :
:
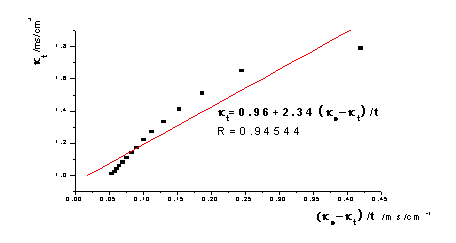
m=2.34,k1=1/(mc0)=1/(2.34*1.9850*0.5*10-2)mol·L-1·min=43.1L/(mol·min)
文献参考值:k(308.2K)=(10±2)L/(mol·min)
b.计算反应的表观活化能:
∵k1/k2=m2/m1
∴ln(k2/k1)=Ea/R·(1/T1-1/T2) ln(m1/m2)=Ea/R·(1/T1-1/T2)
∴Ea=Rln(m1/m2)·[T1T2/(T2-T1)]
=8.314×ln(4.15÷2.34)×[308×299÷(308-299)]J/mol
=48.7kJ/mol
文献值:Ea=46.1kJ/mol
相对误差:(48.7-46.1)÷46.1×100%=5.64%
【结果分析与讨论】
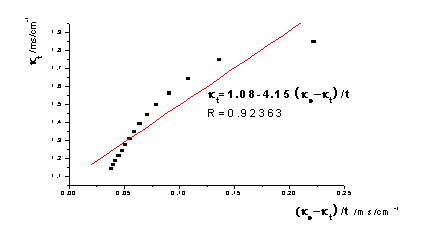
①根据本实验中测定的数据作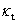 -
- 图,图形为抛物线并非直线:乙酸乙酯皂化反应为吸热反应,混合后体系温度降低,所以在混合后的几分钟所测溶液的电导率偏低。如果从6min开始测定,即去掉前两个数据,重新作图,则
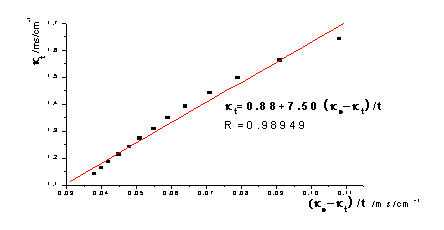
图,图形为抛物线并非直线:乙酸乙酯皂化反应为吸热反应,混合后体系温度降低,所以在混合后的几分钟所测溶液的电导率偏低。如果从6min开始测定,即去掉前两个数据,重新作图,则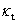 -
- 图线性提高了。以26.0℃数据为例作图对比:
图线性提高了。以26.0℃数据为例作图对比:
去点前:
去点后:
②作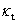 -
- 图得斜率m,根据m求出k值约为文献值的4倍:
图得斜率m,根据m求出k值约为文献值的4倍:
26.0℃:
m=4.15,k1=1/(mc0)=1/(4.15*1.9850*0.5*10-2)mol·L-1·min=24.3L/(mol·min)
文献参考值:k(298.2K)=(6±1)L/(mol·min)
35.0℃:
m=2.34,k1=1/(mc0)=1/(2.34*1.9850*0.5*10-2)mol·L-1·min=43.1L/(mol·min)
文献参考值:k(308.2K)=(10±2)L/(mol·min)
分析原因:实验过程中加入乙酸乙酯后没有充分混合就开始测定,由于电导率仪处于主要是乙酸乙酯的环境氛围内,所以测定的κt偏小,而 值偏大,则作图所得斜率偏小。由于实验过程中,加入乙酸乙酯的操作及插放电导率仪的操作都由我完成的,所以在不同温度下所测定的数据都出现的相同程度的负偏差。
值偏大,则作图所得斜率偏小。由于实验过程中,加入乙酸乙酯的操作及插放电导率仪的操作都由我完成的,所以在不同温度下所测定的数据都出现的相同程度的负偏差。
【提问与思考】
①为何本实验要在恒温条件进行,而CH3COOC2H5和NaOH溶液在混合前还要预先恒温?
答:因为反应速率k受温度的影响大,(kT+10)/kT=2~4,若反应过程中温度变化比较大,则测定的结果产生的误差较大;反应物在混合前就预先恒温是为了保证两者进行反应的时候是相同温度的,防止两者温差带来温度的变化影响测定结果。
②为什么CH3COOC2H5和NaOH起始浓度必须相同,如果不同,试问怎样计算k值?如何从实验结果来验证乙酸乙酯反应为二级反应?
答:因为乙酸乙酯的皂化反应是二级反应,为了简化计算,采用反应物起始浓度相同。如果不同,则k=1/t(a-b)·ln[b(a-x)/a(b-x)]。选择不同浓度的CH3COOC2H5和NaOH溶液,测定不同浓度的反应物在相同反应条件下的反应速率。
③有人提出采用pH法测定乙酸乙酯皂化反应速率常数,此法可行吗?为什么?
答:可以。CH3COOC2H5+OH-=CH3COO-+C2H5OH,反应速率方程为:v=dx/dt=k(a-x)(b-x),当起始浓度相同(a=b),对该式积分简化得:k=x/ta(a-x)。设t时刻溶液的pH值为ε(t),则此时溶液OH-的浓度为ct(OH-)=10(pH-14),即a-x=10(pH-14),ka=[a-10(pH-14)]/[t·10(pH-14)],用a-10(pH-14)对[t·10(pH-14)作图,可得一条直线,该直线的斜率m=ka,即k=m/a。
④为什么要将电导率仪的温度旋钮选为“25”?
答:测量值就是待测液在实际温度下未经补偿的原始电导率值。

